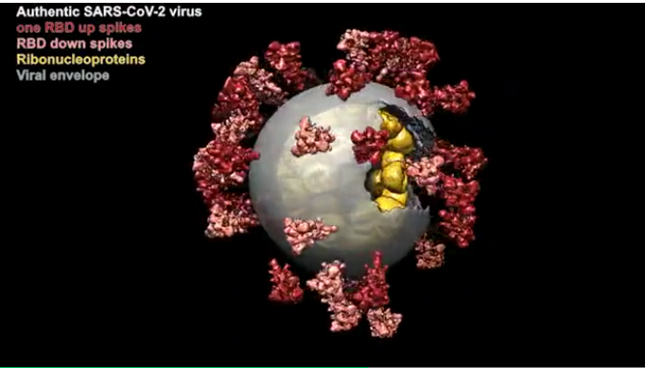
新冠肺炎疫情已成为二战结束后最严重的全球公共卫生突发事件,科学家们也一直致力于揭开它的神秘面纱:新冠病毒为什么传染性这么强?它究竟长什么样?人类如何战胜它?
2020年9月14日,浙江大学医学院附属第一医院传染病诊治国家重点实验室李兰娟院士课题组与清华大学生命学院李赛研究员课题组紧密合作,在国际权威学术杂志《细胞》(Cell,影响因子38.637)在线发表题为“Molecular architecture of the SARS-CoV-2 virus”的研究成果,在国际上首个解析了真实新型冠状病毒全病毒三维精细结构,达到了前所未有的分辨率,并原位揭示了刺突蛋白的天然构像及分布特征,以及核糖核蛋白复合物在病毒体内的结构及分子组装机制,对深入了解新冠病毒的生物特性、疫苗设计、抗病毒药物研发等具有重要意义。
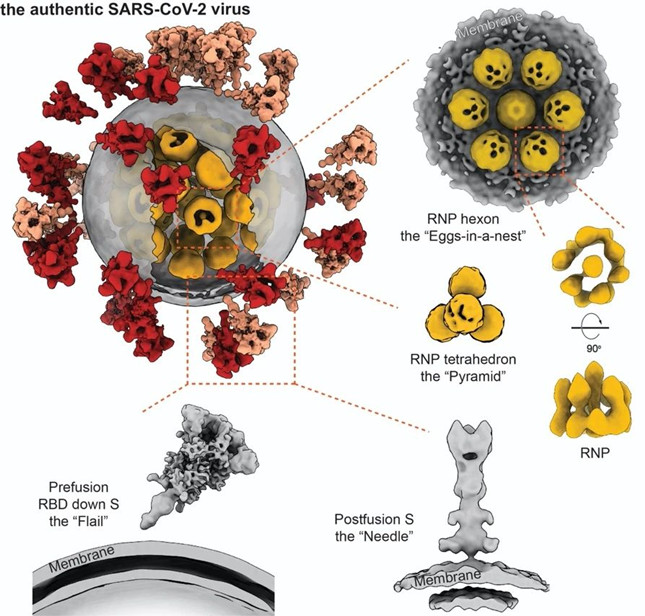
▲全球首个揭示新冠病毒全病毒三维精细结构及核糖核蛋白复合物的分子组装
疫情发生之初,李兰娟院士便带领团队开展病毒生物学研究,一方面,研究人员想要弄清楚新冠病毒与其他冠状病毒和普通的流感病毒等在结构上是否有区别,另一方面,研发疫苗同样也需要对病毒精细结构解析。于是,依托浙大一院传染病国家医学中心领先全国的病毒学研究能力与清华大学生命科学学院强大的结构生物学基础,双方强强联合,历时4个半月开展科研攻关,取得重大突破。
全球首个新冠病毒全病毒结构人类对新冠病毒的认识更进一步
想要解析全病毒精细结构实属不易!进行病毒学研究,需要对病毒进行有效灭活,这一过程中化学灭活剂不恰当使用有可能破坏病毒结构,如何既实现病毒的有效灭活又保证结构完整性?科研团队使出“秘密武器”,利用特殊制样技术解决这一难题。
自2020年1月19日,浙大一院收治杭州市第一例确诊病例,科学研究就与临床救治同时启动了。李兰娟院士团队通过将一名重症患者体内分离得到的病毒株在体外大量培养并有效灭活,利用冷冻电镜断层扫描技术持续对2294颗病毒粒子进行了“高分辨率CT扫描”,从而在电镜下发现了病毒最清晰的真实结构,看上去就像一个太阳一样,形态与其他的冠状病毒并无异,获得了病毒精确的尺寸大小与形态、表面刺突蛋白天然构象与分布、病毒内部核糖核蛋白复合物结构及组装形式等重要信息。
▲新冠病毒的分子结构及其组装机制
在此之前,国际上对新冠病毒结构的研究大都聚焦于某一个蛋白分子,该研究在国际上首个成功揭示了真实的新冠病毒全病毒三维结构,并重构出一个具有代表性的、目前国际上最清晰的3D病毒模型,使“看不见的敌人”清晰地展现在世人面前,对疫苗及抗体研发、抗病毒药物设计及筛选、疫情防控宣传、科普教育等均有十分重要意义。
在病毒身上做研究揭示病毒表面天然结构对疫苗研制、抗病毒药物研发意义重大
冠状病毒因其如日冕般外围的冠状而得名,病毒表面的这些冠状物质叫做刺突蛋白,是一种糖蛋白,也是我们能看到的最直观的病毒结构。它的作用就是感染细胞,可以说是病毒进入人体细胞的“钥匙”,如果没有了刺突蛋白,病毒也就不具有感染性了。
目前大多数对新冠病毒刺突蛋白的研究都是体外重组的,而该研究直接在病毒上开展科研工作,原位解析了新型冠状病毒表面刺突蛋白的天然构像和分布。科研人员发现,新冠病毒的刺突蛋白就像“链锤”一样可以在病毒表面自由摆动,上端粗、下端细,这种特性有助于病毒能灵活“抓住”细胞表面,与之结合入侵细胞,感染人体。
可能新冠病毒也意识到自己已成为全人类的健康公敌,科研人员还发现,它的刺突蛋白的朝向也很有趣,懂得“自我保护”。如果把刺突蛋白比喻成一把伞,雨伞张开被称为“向上”,雨伞关闭被称为“向下”,当刺突蛋白向上时,它就像亮出了自己的武器一样,大喊着“我要去感染细胞了!”此时,如果人体细胞不幸被刺中,那么就面临感染的危险。而当刺突蛋白向下,它就像收起兵器,以免被机体识别击溃。研究发现,新冠病毒的刺突蛋白97%都是向下的,这也就成为它不易被抗体及药物等击败的原因之一。
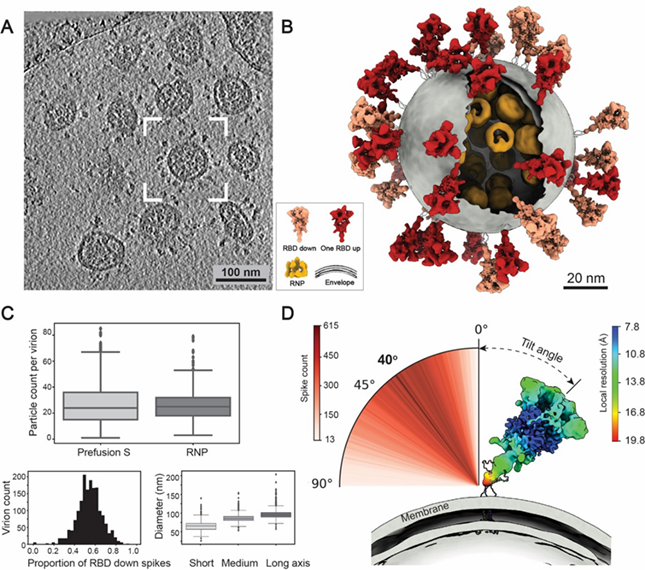
▲新冠病毒的分子结构。SARS-CoV-2病毒体具有代表性的冷冻电镜断层成像照片(A);通过构建RBD“向下”(橙色)和1个RBD“向上”(红色)构象的融合前的S蛋白、脂质包膜(灰色)和核糖核蛋白复合物RNPs(黄色)的模型来重现SARS-CoV-2全病毒三维结构(B);精确计数了每个病毒粒子的刺突蛋白和RNP的数量(C); 揭示最具有代表性的RBD“向下”的S蛋白构象。
目前已经在研制的基因工程疫苗都是基于体外重组表达的刺突蛋白研究成果,这与病毒原位状态下是否存在差异?已研制的疫苗是否对病毒有效?科研团队进一步通过质谱分析刺突蛋白的糖基化组成,发现体外重组表达的刺突蛋白与病毒原位状态刺突蛋白的糖基化修饰具有高度相似性,这对灭活病毒疫苗、基因工程重组疫苗以及中和抗体的研发具有重要指导意义。
新冠病毒为什么可在环境长期存活或许与“病毒灵魂”的组成有关
除了刺突蛋白,新冠病毒的内部结构核心——核糖核蛋白复合物,在该研究中也取得了重要进展。核糖核蛋白复合物是病毒核酸与蛋白的结合体,病毒所有的遗传信息都储存在里面,可以调控病毒的生物特性,可谓是“病毒的灵魂”。
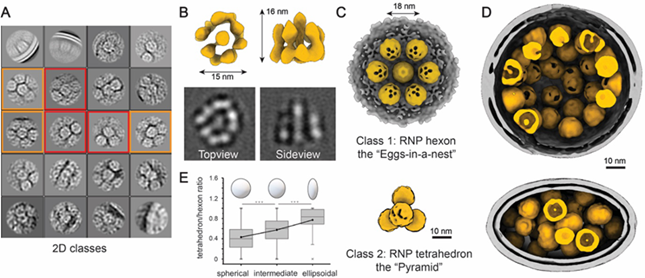
▲核糖核蛋白复合物RNPs的天然结构及其组装机制。显示RNP的两种不同类型的超微结构:六聚体(橙色框)和四聚体(红色框);七个RNP被包裹在病毒包膜内(灰色),形成“巢中蛋”形的六聚体组件,四个RNP被包装成无膜的四聚体组件(下);RNP六聚体组装成球形病毒,四聚体组装成椭球型病毒。
早前的研究发现新冠病毒的核糖核酸长度是同类病毒中最长的,达到病毒自身直径的100倍,那么病毒是如何将达到自身长度100倍的核糖核酸不纠缠、不打结、不断裂、完好无损地装进自己体内的,一直是个未解之谜。科研团队开创性地揭示了病毒腔内核糖核蛋白复合物天然结构及其组装机制,阐明了新冠病毒是如何在80纳米的管腔内组装和堆积单股长达30Kb的核糖核酸。阐明了新冠病毒是如何在80纳米的管腔内组装和堆积单股长达30Kb的核糖核酸。原来,这些复合物像串珠一样把核糖核酸组织在一起,并在病毒体内有序排列,不仅解决了在有限空间内收纳超过自身容量核糖核酸的难题,还加固了病毒本身结构,使它能够经受住人体外复杂环境中的各种理化因素破坏的挑战,这也可以用来解释新冠病毒长期在外环境存活的一个重要因素。
据悉,该研究成果第一作者为浙大一院传染病诊治国家重点实验室姚航平、吴南屏研究员以及清华大学宋雨桐、陈勇、徐家璐,李兰娟院士和李赛研究员为通讯作者。
作者:刘海波 王蕊 胡枭峰 潘磊
编辑:付鑫鑫
责任编辑:蒋萍
*文汇独家稿件,转载请注明出处。





